“人民金融·创新药指数”由证券时报编制,指数每周发布一次。为避免我们资料收集过程中出现遗漏,请创新药研发企业及时将创新药研发进展通报给我们,以便我们及时计入指数并计算权重。联络邮箱:[email protected]
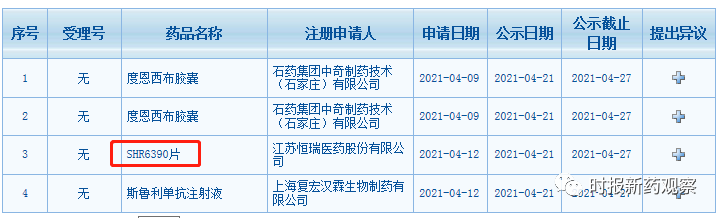
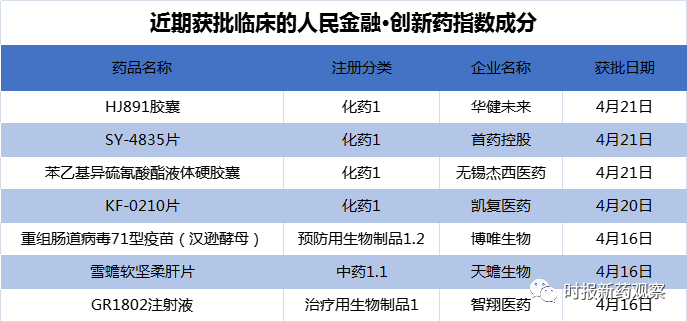
4月21日,恒瑞医药重磅新药SHR6390片上市申请拟纳入优先审评,在绿色通道的加持下,有望成为首个国产CDK4/6抑制剂。同时,在4月16日至4月22日的发布周期内,来自首药控股、凯复医药等的7个创新药首次获批临床,我们将这些品种纳入了“人民金融·创新药指数”。目前,“人民金融·创新药指数”的成分样本共有826个。
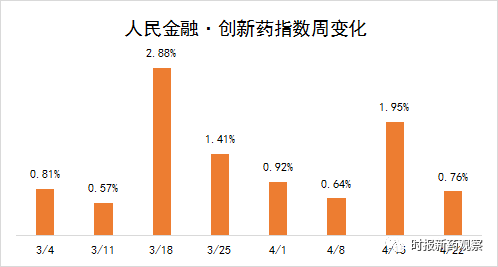
截至4月22日,“人民金融·创新药指数”报1567.35点,在最近一个发布周期内上涨了0.76%。
恒瑞医药重磅新药上市申请拟纳入优先审评
4月21日,国家药监局药审中心网站显示,恒瑞医药SHR6390片的上市申请被拟纳入优先审评。就在上个月,SHR6390片刚被纳入突破性治疗品种。在两个绿色通道的加持下,SHR6390片有望加速获批上市。
恒瑞医药近日发布的2020年报显示,SHR6390是其自主研发并具有知识产权的CDK4/6抑制剂,在体外和体内临床前药效实验中均显示出良好的抗肿瘤活性,动物毒性可控,靶器官明确,预计在多种肿瘤治疗方面将发挥巨大的潜力;报告期内,SHR6390研发投入约1.4亿元。
去年底,恒瑞医药曾表示,其1类新药SHR6390片治疗晚期乳腺癌III期临床研究达到主要研究终点。目前,恒瑞医药正在国内开展SHR6390治疗乳腺癌、晚期实体瘤等适应症的多项临床研究,同时在澳大利亚开展治疗乳腺癌的I期临床研究。
在全球范围内,目前已有四款CDK4/6抑制剂获批,在国内,已有辉瑞和礼来的产品获批。从进度看,恒瑞医药的SHR6390将成为首个国产CDK4/6抑制剂,并且有成为重磅药物的潜力。根据国盛证券的预测,SHR6390的销售峰值为20亿元,西南证券则预计SHR6390峰值销售额有望达到36亿元。
近年来,恒瑞医药形成了每年都有创新药申请临床,每1-2年都有创新药上市的良性发展态势。在恒瑞医药的创新药管线中,目前共有海曲泊帕乙醇胺片、磷酸瑞格列汀片、脯氨酸恒格列净片、SHR6390片4款创新药处于上市申请阶段,其中海曲泊帕乙醇胺片已于上月完成了生产现场检查,磷酸瑞格列汀片和脯氨酸恒格列净片于本月上旬完成生产现场检查,这3个品种均有望在今年获批上市。
另外,恒瑞医药还有法米替尼、SHR1316、SHR3680片、SHR4640片等9个品种处于III期临床阶段。这些品种有望在近两年上市并实现商业化,从而推动公司持续成长。
7个创新药获批临床
新发布周期内,来自首药控股、凯复医药等的7个创新药首次获批临床,我们将这些品种纳入了“人民金融·创新药指数”,新品种的纳入是推升指数走高的主要原因。
4月21日,首药控股的WEE1抑制剂SY-4835片获批临床,成为继“FGFR4抑制剂SY-4798片”和“RET抑制剂SY-5007片”后,首药控股2021年第三个迈入临床阶段的创新药。据悉,SY-4835是首药控股自主研发、具有完全知识产权的新一代高活性WEE1小分子抑制剂。WEE1是肿瘤细胞周期调控的关键蛋白之一,在肿瘤发生、发展过程中发挥重要的生理功能。研究显示,SY-4835可以有效调控多种肿瘤类型的细胞周期和DNA损伤修复,未来可以在多种复发难治性的实体瘤和急性淋巴细胞白血病等血液肿瘤患者中开展临床试验。
4月20日,凯复医药的KF-0210片临床试验申请获默示许可。KF-0210通过对肿瘤微环境的调节作用,增加抗肿瘤免疫功能,从而起到抑制肿瘤生长和转移的作用。KF-0210是凯复医药新药研发管线中首个进入临床研究阶段的项目,目前在澳大利亚和中国共同开展多中心临床研究。上个月,KF-0210在澳大利亚的I期临床完成首例患者给药。
新发布周期内,多个重磅品种临床试验状态向前推进,进一步推升了指数。
药物临床试验登记与信息公示平台显示,恒瑞医药4月19日登记启动了SHR0410注射液用于术后疼痛的III期临床研究。目前,该药正在澳大利亚开展I期临床试验。根据恒瑞医药此前的信息披露,目前国内外暂无同类产品上市,在研同类产品在美国处于Ⅲ期临床研究阶段。
近日,科望生物登记启动了ES101治疗晚期恶性胸部肿瘤受试者的1b/2期临床试验,ES101注射液是科望生物的全球首创、四价双特异性抗体,有望为肿瘤患者带来PD-1/PD-L1之后的全新的治疗方案。
福瑞他恩是开拓药业自主研发的潜在first-in-class创新药物。最近开拓药业公告,福瑞他恩凝胶针对痤疮适应症的临床试验已于中国完成首批患者招募并成功给药。针对雄激素脱发适应症,福瑞他恩目前正在中国进行II期临床试验。中国目前尚无有效的局部雄激素受体拮抗剂可用于痤疮的治疗,市场未被满足的临床需求很大。